U svakoj nauci postoji potreba za sređivanje tj. grupisanje podataka. Jedna od osnovnih potreba sređivanja podataka u hemiji svakako je klasifikacija supstanci. Ta potreba je rasla sa otkrivanjem novih elemenata. Ovaj veliki poduhvat i izazov rešio je ruski hemičar Dimitrij Ivanovič Mendeljejev u 19. veku.
Sistematizacija hemijskih elemenata započeta je u 17. veku. Hemičar Robert Boji vrši sistematizaciju elemenata po porastu relativne atomske mase (do tada ukupno poznatih 13 elementa). Lavoazije dodaje još 11 elemenata. Oni su elemente klasifikovali na gasove ,metale,nemetale..
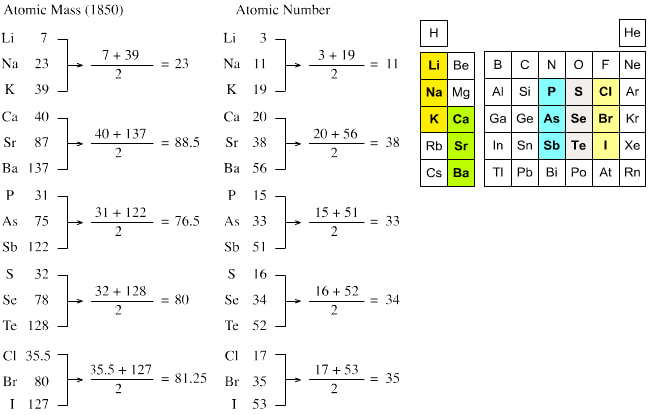
.Johan Deberajner uvodi po prvi put trijade. Naime on je uočio da mnogi elementi mogu da se grupišu u trojstva na osnovu njihovih hemijskih svojstava.
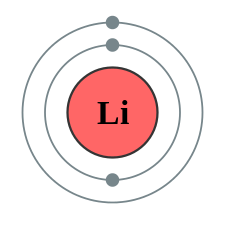
Litijum,kalijum i natrijum zajedno su grupisani u trojstvo kao meki i reaktivni metali.
Obrati pažnju! Iako su hemičari mogli da grupišu elemente u manje grupe i dalje je postojala potreba za univerzalnim sistemom klasifikacije elemenata.
Đžon Njulends uvodi pravilo da se elementi ređaju prema njihovim atomskim masama. Takođe uočio je da se određene hemijske osobine ponavljuju kod svakog osmog elementa.
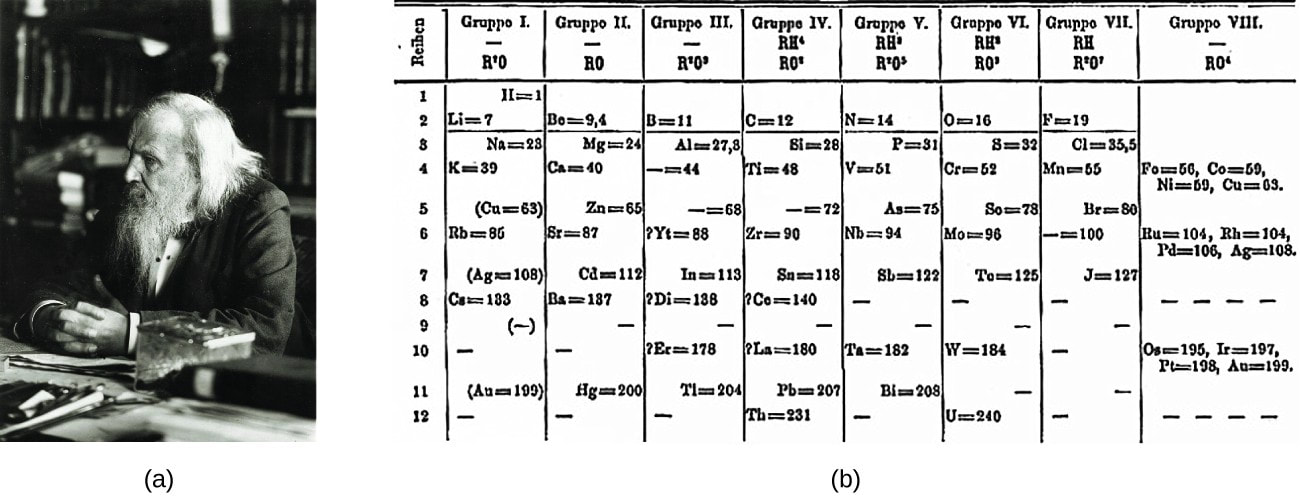
Sad na scenu sutpa Mendeljejev koji se rukovodio sličnom po sličnom principu kao i Džon Njulends.
Mendeljejev je ređao hemijske elemente u niz na osnovu njihove atomske mase. Prvi u nizu bio je element sa najmanjom atomskom masom, a zatim je nastavio da ređa elemente sa sve većim masama. Pritom svaki element je dobio svoje mesto i redni broj. On je isto zaključio da su svojstva svakog osmog elementa slična tj. da se svojstva elemenata periodično ponavljaju.
Na osnovu toga on je formulisao i definisao zakon periodičnosti. Prema tom zakonu , svojstva elemenata se periodično ponavljaju jer zavise od njihovih atomskih masa. Takođe je utvrđeno da su redni brojevi elementa u periodnom sistemu zapravo njihovi atomski brojevi.
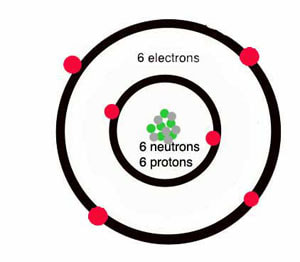
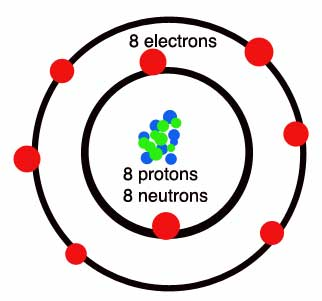
Podsetimo se da atomski broj predstavlja broj protona u jezgru, odnosno broj neutrona u elektronskom omotaču.
Zbog toga možemo reći da se svojstva elemenata periodično ponavljaju jer zavise od atomskih brojeva elemenata.
Mendeljejev je elemnte sa sličnim svojstvima stavljao jedne ispod drugih i na taj način stvorio tabelarni pregled elemenata odnosno periodni sistem elemenata.
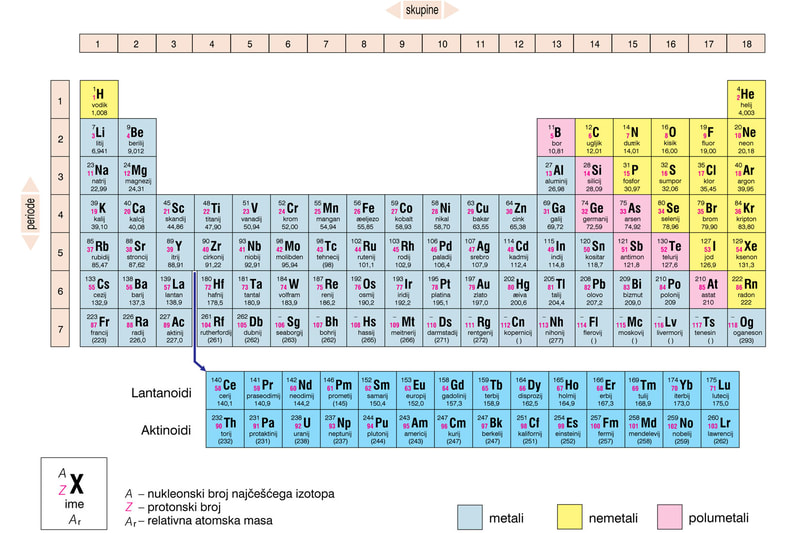
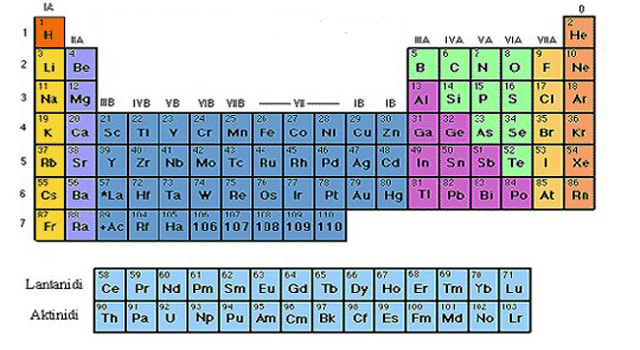
Periodni sistem elemenata (PSE) ima 118 hemijskih elemenata i to su metali, nemetali, metaloidi i plemeniti gasovi. Periodni sistem ima sedam vodoravnih redova koji se nazivaju periode. Periode se obeležavaju arapskim ciframa.
Uoči i zaključi! Zbog čega periodni sistem ima 7 perioda. Zbog toga što ima ukupno 7 energetskih nivoa u elektronskom omotaču (k,l,m,n,o,p,q)
U Periodnom sistemu elemenata prva perioda je najkraća - sadrži svega dva elementa: vodonik i helijum. Kod atoma oba ova elementa prvi nivo je ujedno i valentni. Vodonik ima jedan valentni elektron, a helijum dva i to mu daje stabilnost. Zato je smešten u poslednju grupu, gde su plemeniti gasovi, koji imaju maksimalno popunjene valentne nivoe i zato su stabilni. Druga i treća perioda su kratke periode, jer sadrže po osam elemenata. Prvi u svakoj od njih ima jedan valentni elektron, sledeći dva, pa sledeći tri i tako redom - do plemenitih gasova, koji imaju po osam. Preostale četiri periode su duge periode, jer sadrže više od osam hemijskih elemenata.
Zbog čega su dve periode izdvojene?
Šestoj periodi pripadaju lantanoidi , dok sedmoj pripadaju aktinoidi ovi elementi su izdvojeni zbog jednostavnijeg grafičkog prikaza. Hemijski elementi koji pripadaju istoj periodi imaju isti broj energetskih nivoa.
Prvi element u periodi ima samo jedan valentni elektron dok poslednji ima popunjen poslednji energetski nivo, odnosno 8 valentnih elektrona (izuzetak je helijum).
Uspravni redovi u PSE nazivaju se grupe. U periodnom sistemu postoje 18 grupa koje se obeležavaju arapskim brojevima od 1 do 18. Elementi koji pripadaju istoj grupi imaju isti broj valentnih elektrona na poslednjem energetskom nivou i slična hemijska svojstva.
Reakcija alkalnih metala sa vodom. Svi alkalni metali slično reaguju sa vodom samo se razlikuju po intenzitetu reakcije.
Ranije sus e grupe u PSE obeležavale rimskim brojevima od I do VII sa a i b grupama, dok su plemeniti gasovi bili 0. grupa.
Mendeljejev nije posedovao ni trunčicu galijuma, niti je uopšte pokušavao da ga izoluje. A ipak je znao ne samo specifičnu težinu i gustinu novog elementa, već i njegovu tačku topljenja, električnu i toplotnu provodljivost, kao i osobine nekih njegovih jednostavnijih jedinjenja, poput oksida Ga2O3! Kako je to moguće? |
PSE from Marija Bozic