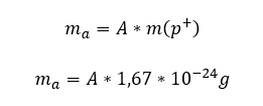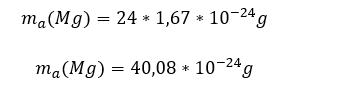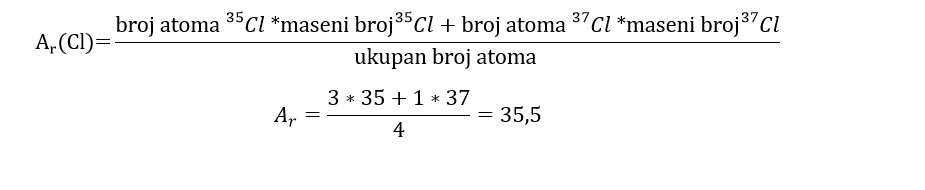Stvarna odnosno apsolutna masa atoma nekog elementa može se izračunati kada se broj nukleona (čestica koje čine jezgro odnosno protoni i neutroni) pomnožoi masom protona (mase protona i neutrona su približno jednake. Kako je broj nukleona jedank masenom broju formulu za izračunavanje apsolutne mase možemo matematički predstaviti na sledeći način.
Masa elektrona nije uzeta u obzir zbog toga što je mnogo manja od mase protona tačnije 1837 puta manja od mase protona. Iz navedenog primera i formule se vidi da je apsolutna masa atoma veoma mala vrednost i zbog toga se u hemiji uvodi pojam relativne atomske mase.
Sigurno si do sada u svakodnevnom često susreo sa pojmom "relativno" tj. relativitetom. Relativno je prilog latinskog porekla, nastao od latinske reči relative, što u prevodu znači – srazmerno, odnosno; u odnosu na druge mogućnosti ili pojave i slično. Suprotan ovom pojmu je pojam – apsolutno.
Dakle iz samog naziva se zaključuje da se stvarna masa poredi sa nekom drugom masom. Dakle relativna atomska masa (Ar) jeste broj koji pokazuje koliko je puta stvarna masa atoma nekog elementa veća od 1/12 mase atoma ugljenikovog izotopa C-12.
Pojam relativne mase atoma možemo uporediti sa sledećim primerom. Pobednik na Kalemegdanu visok je 15 metara, Big Ben 95 metara , a Ajfelova kula 300 metara. Visinu svih spomenika možemo izraziti preko Pobednika, te je relativna visina Pobednika 1, Big bena 6,33 , a Ajfelove kule 20.
Uf- ova definicija zvuči komplikovano, ali zapravo je veoma jednostavna i u to se možeš uveriti u nastavku lekcije.
Relativna atomska masa predstavlja količnik dveju veličina koje se mere istim jedinicama i zbog toga ona je bezdimenzionalna veličina tj. nema mernu jedinicu.
Atom ugljenikovog izotopa C-12 ima u svom jezgru 12 nukleona , što znači da je 1/12 mase izotopa C-12 zapravo masa jednog protona. To je takođe i unificirana atomska jedinica , obeležava se malim latiničnim slovom u. Preko unificirane atomske jedinice možemo formulisati izraz za relativnu atomsku masu.
Zašto relativne atomske mase nekih elemenata nisu celi brojevi.
S obzirom da se hemijski elementi u prirodi javljaju u vidu više izotopa (koji imaju različit broj neutrona), prilikom računanja relativne atomske mase, treba uzeti u obzir i masu i učestalost svakog do njih. Zato relativne atomske mase najčešće nisu celi brojevi, dok maseni brojevi jesu.
Primer 1: Odrediti relativnu atomsku masu silicijuma koji ima tri izotpa čija je zastpuljenost u prirodi sledeća:
Si-28 92% , Si-29 5% , Si-30 3%
Si-28 92% , Si-29 5% , Si-30 3%
Primer 2: Od 4 atoma hlora, 3 atoma imaju maseni broj 35, a jedan ima maseni broj 37, odrediti relativnu atomsku masu.
U ovoj igrici možete da vagate razne atome (tj. da im očitavate relativne atomske mase) i pri tome da im oduzimate ili dodajete neutrone. Sa desne strane možete da vidite da li ste dodavanjem ili oduzimanjem tih čestica dobili izotop koji postoji, kolika mu je zastupljenost u prirodi i koliki mu je atomski i maseni broj (te kako se pišu uz hemijski simbol).